4.10 Stavová rovnica ideálneho plynu. Deje v plynoch
Znenie:
SÚČIN TLAKU A OBJEMU VYDELENÝ TEPLOTOU JE PRE IDEÁLNY PLYN ROVNAKÝ.
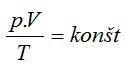
Opis matematického zápisu:
p [Pa] – tlak
V [m³] – objem
T [K] – termodynamická teplota
Izobarický dej - zachováva sa tlak v plyne: p = konšt.
Ak zohrejeme nádobu s plynom a tlak sa má zachovať, musí sa zväčšiť jeho objem.
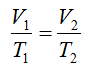
Opis matematického zápisu:
V1[m³],V2[m³] – objem plynu na začiatku a konci deja
T1[K], T2[K] – teplota plynu na začiatku a konci deja
Stavová rovnica pre izobarický dej:
OBJEM PLYNU JE PRIAMOÚMERNÝ JEHO TEPLOTE
– Gay-Lussacov zákon (Gej-Lusakov zákon).
Grafom pV diagrame je úsečka rovnobežná s vodorovnou objemovou osou - IZOBARA.
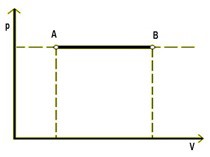
Izochorický dej - zachováva sa objem plynu: V = konšt.
Ak zohrejeme pevne uzavretú nádobu s plynom,musí sa zvýšiť tlak v plyne.
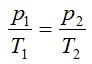
Opis matematického zápisu:
p1[Pa], p2[Pa] - tlak plynu na začiatku a konci deja
T1[K], T2[K] - teplota plynu na začiatku a konci deja
Stavová rovnica pre izochorický dej:
TLAK PLYNU JE PRIAMOÚMERNÝ JEHO TELOTE.
– Charlov zákon (Šarlov zákon).
Grafom v pV diagrame je úsečka rovnobežná so zvislou tlakovou osou – IZOCHORA
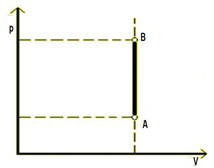
Izotermický dej - zachováva sa teplota plynu T = konšt.
Ak zohrejeme nádobu s plynom uzavretú piestom a teplota sa má zachovať, musí sa zväčšiť objem a znížiť tlak.
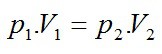
Opis matematického zápisu:
p1[Pa], p2[Pa] – tlak plynu na začiatku a konci deja
V1[m³], V2[m³] - objem plynu na začiatku a konci deja
Stavová rovnica pre izotermický dej: SÚČIN TLAKU A OBJEMU PLYNU JE STÁLY
– Boylov-Mariottov (Bojlov-Mariotov) zákon.
Grafom v pV diagrame je vetva hyperboly – IZOTERMA:
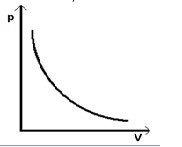
Adiabatický dej - plyn neprijíma ani neodovzdáva teplo: Q = 0.
Ak plyn rýchlo stlačíme, zohreje sa; ak sa plyn rýchlo rozpína, ochladí sa.
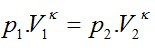
Opis matematického zápisu:
p1[Pa], p2[Pa] – tlak plynu na začiatku a konci deja
V1[m³], V2[m³] - objem plynu na začiatku a konci deja
![]()
– POISSONOVA KONŠTANTA – číslo, ktorého hodnoty pre niektoré plyny sú uvedené v MFCHT.
Adiabata klesá rýchlejšie izoterma. Pre adiabatický dej platí Poissonov
(poasonov) zákon:
súčin tlaku a objemu plynu umocneného Poissonovou konštantou je STÁLY.
Grafom v PV – diagrame je posunuté rameno hyperboly – ADIABATA.
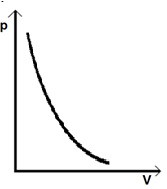
Príklady na adiabatický dej v plynoch:
-
vo vznetových motoroch sa adiabatickou kompresiou zvýši teplota vzduchu na zápalnú teplotu nafty, ktorá sa po vstreknutí do horúceho vzduchu vznieti.
-
ochladenie plynu adiabatickou expanziou sa využíva na získanie nízkych teplôt.
-
obsah sifónovej bombičky po náhlom zväčšení objemu CO2 sa ochladí.
Molekulová fyzika a termodynamika

